Funktionsprinzip der Batterie
Wie funktionieren eine Wanduhr, eine TV-Fernbedienung oder ein funkgesteuertes Kinderspielzeug? Die meisten Menschen werden ohne zu zögern mit „aus Batterien“ antworten und im Prinzip Recht haben. Es ist jedoch unwahrscheinlich, dass einer von ihnen sagen kann, wie genau die tragbare Batterie verdreifacht wird, wie sie funktioniert und ohne die der gesamte Prozess der Übertragung des elektrischen Stroms von der Batterie zum Endverbraucher unmöglich wäre. Lassen Sie uns diese lästige Wissenslücke schließen.
Der Inhalt des Artikels
Funktionsprinzip der Batterie
Um das Funktionsprinzip einer herkömmlichen AA-Batterie zu verstehen, müssen Sie über ein allgemeines Verständnis ihres Aufbaus verfügen. Jede Batterie besteht also aus drei Hauptelementen – Anode, Kathode und Elektrolyt. Letztere können darüber hinaus nahezu jeden Aggregatzustand annehmen: Kathode und Anode in einer Salzlösung sind im Prinzip auch eine „Batterie“, nur in einer für den Durchschnittsmenschen ungewöhnlichen Form.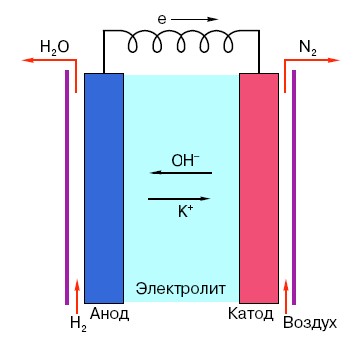
Interessant! Auch die sogenannte „Voltaische Säule“, erfunden von Alessandro Volta, verfügte über alle notwendigen Elemente zur Erzeugung von elektrischem Strom. Es bestand aus übereinander gestapelten Zink- und Kupferplatten, zwischen die als „Schicht“ ein mit Säure getränktes Tuch gelegt wurde.
Die Anode in solchen Systemen ist die Hauptquelle für Elektronen, die, wie wir aus dem Physikunterricht in der Schule wissen, eine negative Ladung haben.Negativ geladene Teilchen werden von positiven angezogen, und in diesem Fall fungiert die Kathodenoberfläche als „Plus“.
Dies reicht jedoch nicht aus, damit ein elektrischer Strom entsteht, denn auch Elektronen benötigen eine Art „Autobahn“ – ein Medium, das die Wechselwirkung von Kathode und Anode unterstützt. Hier erscheint „auf der Bühne“ ein Elektrolyt – ein Salz, eine Lauge oder eine Säure, die Strom leiten kann.
Schauen wir uns das Funktionsprinzip anhand eines konkreten Beispiels an: Es gibt eine Batterie mit einer Nennspannung von 18 Volt. Die Spannung zwischen den darin enthaltenen Elektroden bleibt stabil, bis sie an das Netzwerk angeschlossen wird. Sobald ein Verbraucher erscheint (z. B. eine gewöhnliche Glühbirne), beginnt die Spannung allmählich abzunehmen, Strom beginnt von der „negativen“ Elektrode zur „positiven“ zu fließen und im angestrebten Elektrolyten kommt es zu einer chemischen Reaktion Aufrechterhaltung der Potentialdifferenz zwischen den Elektroden.
Referenz. Je mehr Energie der Verbraucher benötigt, desto intensiver ist die Reaktion im Inneren der Batterie und desto schneller fällt sie aus.
Wie ein Akku funktioniert und wie er sich von einem normalen unterscheidet
Wir haben uns also die klassischen „Finger“- und „Kleinfinger“-Batterien angeschaut und wissen, dass die Lebensdauer der meisten von ihnen streng begrenzt ist (egal, was namhafte Hersteller sagen). Aber was ist mit den sogenannten Batterien – batterieähnlichen Batterien, die während des Reaktionsprozesses nicht nur Energie verbrauchen, sondern diese auch ansammeln und über einen längeren Zeitraum speichern können?
Um das Funktionsprinzip der Batterie zu verstehen, ist es notwendig, sich der Chemie zuzuwenden. Nehmen wir als Beispiel... Ein normales Holzkohlefeuer.So schön und faszinierend die Flamme auch aussieht, jeder Chemiker, der sie beobachtet, weiß, dass dieser Prozess nur eine Langzeitreaktion der Kraftstoffoxidation ist. Brennende Kohle interagiert mit Sauerstoff und als Ergebnis dieser Reaktion erhalten wir:
- Kohlendioxid;
- Licht;
- warm.
Und wenn die letzten beiden Punkte in der Lage sind, Seele und Körper zu erwärmen, dann können wir Kohlendioxid in keiner Weise nutzen, denn es ist ein Nebenprodukt der Reaktion, das eigentlich ihr Abfall ist. Die Oxidationsreaktion stoppt, wenn die Ausgangselemente Sauerstoff und Kohle aufgebraucht sind. Das Stoppen der Reaktion in einer Batterie erfolgt genauso, wenn die Ausgangsstoffe vollständig erschöpft sind und nur noch „Abfall“ übrig bleibt.
Bei der Batterie läuft alles etwas anders ab. Tatsache ist, dass die darin ablaufende Reaktion zur Kategorie der reversiblen Reaktion gehört, das heißt, sie kann unter bestimmten Bedingungen „umgekehrt“ werden und alle Stoffe in ihren ursprünglichen Zustand zurückversetzen. Es besteht die Möglichkeit einer reversiblen Reaktion in der Batterie, die das Laden ermöglicht.
In einer an das Netzwerk angeschlossenen Batterie verläuft die Reaktion in die entgegengesetzte Richtung und der Strom fließt von „Plus“ nach „Minus“ und nicht umgekehrt. Dadurch bildet das Reaktionsprodukt die Ausgangsstoffe und der Besitzer der Batterie erhält verfügbare „zurückgewonnene“ Energie in einem tragbaren Format. Das ist alles!





